HIV
| İnsan immün yetmezlik virüsleri ⓘ | |
|---|---|

| |
| Kültürlenmiş lenfositten tomurcuklanan HIV-1'in (yeşil renkte) taramalı elektron mikrografı. Hücre yüzeyindeki çok sayıda yuvarlak tümsek, viryonların birleşme ve tomurcuklanma bölgelerini temsil etmektedir. | |
| Bilimsel sınıflandırma | |
| (sırasız): | Virüs |
| Diyar: | Riboviria |
| Krallık: | Pararnavirae |
| Filum: | Artverviricota |
| Sınıf: | Revtraviricetes |
| Sipariş: | Ortervirales |
| Aile: | Retroviridae |
| Alt familya: | Orthoretrovirinae |
| Cins: | Lentivirüs |
| Dahil olan gruplar | |
| |
| Diğer lentivirüsler | |
| |
İnsan immün yetmezlik virüsleri (HIV), insanları enfekte eden iki Lentivirüs (bir retrovirüs alt grubu) türüdür. Zamanla, bağışıklık sisteminin ilerleyen başarısızlığının hayatı tehdit eden fırsatçı enfeksiyonların ve kanserlerin gelişmesine izin verdiği bir durum olan edinilmiş immün yetmezlik sendromuna (AIDS) neden olurlar. Tedavi olmaksızın, HIV enfeksiyonundan sonra ortalama hayatta kalma süresinin HIV alt tipine bağlı olarak 9 ila 11 yıl olduğu tahmin edilmektedir. ⓘ
Çoğu durumda, HIV cinsel yolla bulaşan bir enfeksiyondur ve kan, ön ejakülat, meni ve vajinal sıvılarla temas veya bunların aktarılmasıyla meydana gelir. Cinsel olmayan yolla bulaşma, enfekte bir anneden bebeğine hamilelik sırasında, doğum sırasında annenin kanına veya vajinal sıvısına maruz kalma ve anne sütü yoluyla gerçekleşebilir. Bu vücut sıvıları içerisinde HIV hem serbest virüs partikülleri hem de enfekte olmuş bağışıklık hücreleri içerisinde virüs olarak bulunur. Araştırmalar (hem aynı cinsiyetten hem de karşı cinsiyetten çiftler için) HIV pozitif partnerin viral yükü sürekli olarak tespit edilemiyorsa HIV'in kondomsuz cinsel ilişki yoluyla aktarılamayacağını göstermiştir. ⓘ
HIV, insan bağışıklık sistemindeki yardımcı T hücreleri (özellikle CD4+ T hücreleri), makrofajlar ve dendritik hücreler gibi hayati hücreleri enfekte eder. HIV enfeksiyonu, abortif olarak enfekte olmuş T hücrelerinin piroptozisi, enfekte olmamış seyirci hücrelerin apoptozisi, enfekte olmuş hücrelerin doğrudan viral öldürülmesi ve enfekte olmuş CD4+ T hücrelerinin enfekte olmuş hücreleri tanıyan CD8+ sitotoksik lenfositler tarafından öldürülmesi gibi bir dizi mekanizma yoluyla CD4+ T hücrelerinin düşük seviyelerde kalmasına yol açar. CD4+ T hücre sayıları kritik bir düzeyin altına düştüğünde, hücre aracılı bağışıklık kaybolur ve vücut fırsatçı enfeksiyonlara karşı giderek daha duyarlı hale gelerek AIDS'in gelişmesine yol açar. ⓘ
HIV (İngilizce: Human Immunodeficiency Virus/Türkçe: İnsan Bağışıklık Yetmezliği Virüsü), AIDS'e yol açan virüs. HIV, bağışıklık sistemine zarar vererek hastalığa neden olur. Vücudu mikroorganizmalardan koruyan bağışıklık sistemi çalışmadığında, mikroorganizmalar hastalığa daha kolay neden olabilir. ⓘ
Kanında HIV bulunmayan kişiler HIV negatif kişilerdir. Kanında HIV ile enfekte olan kişilere "HIV pozitif" veya "HIV ile yaşayan kişi" denir. Bu kişiler aynı zamanda kanında antikor bulunan anlamında sero (anti-HIV, veya bilinen ismiyle ELISA testi) pozitif kişilerdir. Ancak ilk bulaşma döneminde seronegatif kişiler aynı zamanda enfeksiyon taşıyan kişiler olabilirler. ⓘ
Viroloji
Sınıflandırma
| Türler | Virülans | Bulaşıcılık | Yaygınlık | Çıkarılan köken |
|---|---|---|---|---|
| HIV-1 | Yüksek | Yüksek | Küresel | Yaygın şempanze |
| HIV-2 | Daha düşük | Düşük | Batı Afrika | İsli mangabey |
HIV, Retroviridae ailesinin bir parçası olan Lentivirüs cinsinin bir üyesidir. Lentivirüsler birçok ortak morfolojiye ve biyolojik özelliğe sahiptir. Birçok tür, karakteristik olarak uzun kuluçka dönemine sahip uzun süreli hastalıklardan sorumlu olan lentivirüsler tarafından enfekte edilir. Lentivirüsler tek sarmallı, pozitif anlamlı, zarflı RNA virüsleri olarak bulaşır. Hedef hücreye girdikten sonra viral RNA genomu, virüs partikülünde viral genomla birlikte taşınan viral olarak kodlanmış bir enzim olan ters transkriptaz tarafından çift sarmallı DNA'ya dönüştürülür (ters transkripsiyon). Ortaya çıkan viral DNA daha sonra hücre çekirdeğine aktarılır ve viral olarak kodlanmış bir enzim olan integraz ve konakçı ko-faktörleri tarafından hücresel DNA'ya entegre edilir. Entegre olduktan sonra, virüs latent hale gelebilir, bu da virüsün ve konak hücresinin belirsiz bir süre boyunca bağışıklık sistemi tarafından tespit edilmekten kaçınmasına izin verir. HIV virüsü, birincil enfeksiyondan sonra insan vücudunda on yıla kadar uykuda kalabilir; bu süre zarfında virüs semptomlara neden olmaz. Alternatif olarak, entegre viral DNA kopyalanabilir, konak hücre kaynakları kullanılarak yeni RNA genomları ve viral proteinler üretilebilir, bunlar paketlenir ve replikasyon döngüsüne yeniden başlayacak yeni virüs partikülleri olarak hücreden salınır. ⓘ
İki tip HIV karakterize edilmiştir: HIV-1 ve HIV-2. HIV-1 ilk keşfedilen ve hem lenfadenopati ilişkili virüs (LAV) hem de insan T-lenfotropik virüs 3 (HTLV-III) olarak adlandırılan virüstür. HIV-1, HIV-2'den daha virülan ve daha enfektiftir ve küresel olarak HIV enfeksiyonlarının çoğunun nedenidir. HIV-2'nin HIV-1'e kıyasla daha düşük enfektivitesi, HIV-2'ye maruz kalanların daha azının maruz kalma başına enfekte olacağı anlamına gelir. Nispeten zayıf bulaşma kapasitesi nedeniyle HIV-2 büyük ölçüde Batı Afrika ile sınırlıdır. ⓘ
Yapısı ve genomu

HIV yapı olarak diğer retrovirüslere benzer. Yaklaşık 120 nm çapında kabaca küresel bir yapıya sahiptir ve hacim olarak bir kırmızı kan hücresinden yaklaşık 100.000 kat daha küçüktür. Viral protein p24'ün 2.000 kopyasından oluşan konik bir kapsid tarafından çevrelenen virüsün dokuz genini kodlayan pozitif anlamlı tek sarmallı RNA'nın iki kopyasından oluşur. Tek sarmallı RNA, nükleokapsid proteinlerine, p7'ye ve ters transkriptaz, proteazlar, ribonükleaz ve integraz gibi virionun gelişimi için gerekli enzimlere sıkıca bağlıdır. Viral protein p17'den oluşan bir matris kapsidi çevreleyerek virion partikülünün bütünlüğünü sağlar. ⓘ
Bu da, yeni oluşan virüs partikülü hücreden tomurcuklandığında bir insan konak hücresinin zarından alınan lipit çift tabakadan oluşan viral zarfla çevrilidir. Viral zarf, konak hücreden gelen proteinleri ve glikoprotein (gp) 120 olarak bilinen üç molekülden oluşan bir başlık ve yapıyı viral zarfın içine sabitleyen üç gp41 molekülünden oluşan bir gövdeden oluşan HIV zarf proteininin nispeten az sayıda kopyasını içerir. HIV env geni tarafından kodlanan zarf proteini, virüsün hedef hücrelere tutunmasını ve viral zarfın hedef hücrenin zarıyla kaynaşmasını sağlayarak viral içeriği hücre içine salar ve bulaşıcı döngüyü başlatır. ⓘ

Virüsün yüzeyindeki tek viral protein olan zarf proteini, HIV aşı çalışmaları için önemli bir hedeftir. Trimerik zarf spike kütlesinin yarısından fazlası N-bağlı glikanlardır. Glikanlar, altta yatan viral proteini antikorlar tarafından nötralize edilmekten koruduğu için yoğunluk yüksektir. Bu, bilinen en yoğun glikozillenmiş moleküllerden biridir ve yoğunluk, endoplazmik ve Golgi aparatında biyogenez sırasında glikanların normal olgunlaşma sürecini engelleyecek kadar yüksektir. Bu nedenle glikanların çoğu, normalde salgılanan veya hücre yüzeyinde bulunan insan glikoproteinlerinde bulunmayan olgunlaşmamış 'yüksek manozlu' glikanlar olarak durmaktadır. Olağandışı işleme ve yüksek yoğunluk, şimdiye kadar tanımlanmış olan (aylarca veya yıllarca enfekte olmuş hastaların bir alt kümesinden) neredeyse tüm geniş nötralize edici antikorların bu zarf glikanlarına bağlandığı veya bunlarla başa çıkacak şekilde uyarlandığı anlamına gelmektedir. ⓘ
Viral spike'ın moleküler yapısı artık X-ışını kristalografisi ve kriyojenik elektron mikroskopisi ile belirlenmiştir. Yapısal biyolojideki bu ilerlemeler, gp41'de alt birimler arası bir disülfit bağı ve izolösinden proline mutasyon (bir amino asidin radikal değişimi) eklenerek viral spike'ın stabil rekombinant formlarının geliştirilmesi sayesinde mümkün olmuştur. SOSIP trimerleri olarak adlandırılanlar sadece doğal viral spike'ın antijenik özelliklerini yeniden üretmekle kalmaz, aynı zamanda doğal virüste sunulanla aynı derecede olgunlaşmamış glikanlar da sergiler. Rekombinant trimerik viral sivri uçlar, hedef epitoplara karşı bağışıklık tepkisini bastırmak üzere hareket eden rekombinant monomerik gp120'den daha az nötralize edici olmayan epitoplar gösterdikleri için umut verici aşı adaylarıdır. ⓘ

RNA genomu en az yedi yapısal işaretten (LTR, TAR, RRE, PE, SLIP, CRS ve INS) ve 19 proteini kodlayan dokuz genden (gag, pol ve env, tat, rev, nef, vif, vpr, vpu ve bazen tat, env ve rev'in bir füzyonu olan onuncu bir tev) oluşur. Bu genlerden üçü, gag, pol ve env, yeni virüs partikülleri için yapısal proteinleri yapmak için gerekli bilgileri içerir. Örneğin env, gp120 ve gp41'i oluşturmak üzere hücresel bir proteaz tarafından ikiye bölünen gp160 adlı bir proteini kodlar. Kalan altı gen, tat, rev, nef, vif, vpr ve vpu (veya HIV-2 durumunda vpx), HIV'in hücreleri enfekte etme, yeni virüs kopyaları üretme (replike olma) veya hastalığa neden olma yeteneğini kontrol eden proteinler için düzenleyici genlerdir. ⓘ
İki tat proteini (p16 ve p14), TAR RNA elemanını bağlayarak hareket eden LTR promotörü için transkripsiyonel transaktivatörlerdir. TAR ayrıca apoptoz genleri ERCC1 ve IER3'ü düzenleyen mikroRNA'lara da işlenebilir. Rev proteini (p19), RRE RNA elementine bağlanarak RNA'ların çekirdekten sitoplazmaya taşınmasında rol oynar. vif proteini (p23) APOBEC3G'nin (tek sarmallı viral DNA'da sitidini üridine deamine eden ve/veya ters transkripsiyona müdahale eden hücresel bir protein) etkisini önler. Vpr proteini (p14) hücre bölünmesini G2/M'de durdurur. Nef proteini (p27) CD4'ün (başlıca viral reseptör) yanı sıra MHC sınıf I ve sınıf II moleküllerini aşağı doğru düzenler. ⓘ
Nef ayrıca SH3 alanları ile etkileşime girer. Vpu proteini (p16) enfekte hücrelerden yeni virüs partiküllerinin salınmasını etkiler. HIV RNA'sının her bir ipliğinin uçları uzun terminal tekrarı (LTR) adı verilen bir RNA dizisi içerir. LTR'deki bölgeler yeni virüslerin üretimini kontrol etmek için anahtar görevi görür ve HIV ya da konak hücreden gelen proteinler tarafından tetiklenebilir. Psi elementi viral genom paketlemesinde rol oynar ve gag ve rev proteinleri tarafından tanınır. SLIP elemanı (TTTTTT) işlevsel pol yapmak için gereken gag-pol okuma çerçevesindeki çerçeve kaymasında rol oynar. ⓘ
Tropizm

Viral tropizm terimi, bir virüsün enfekte ettiği hücre tiplerini ifade eder. HIV, CD4+ T hücreleri, makrofajlar ve mikroglial hücreler gibi çeşitli bağışıklık hücrelerini enfekte edebilir. HIV-1'in makrofajlara ve CD4+ T hücrelerine girişi, virion zarf glikoproteinlerinin (gp120) hedef hücrelerin membranındaki CD4 molekülü ve ayrıca kemokin yardımcı reseptörleri ile etkileşimi yoluyla gerçekleşir. ⓘ
HIV-1'in makrofaj-tropik (M-tropik) suşları veya sinsitya oluşturmayan suşları (NSI; artık R5 virüsleri olarak adlandırılmaktadır) giriş için β-kemokin reseptörü CCR5'i kullanır ve böylece hem makrofajlarda hem de CD4+ T hücrelerinde çoğalabilir. Bu CCR5 eş reseptörü, viral genetik alt tipten bağımsız olarak neredeyse tüm birincil HIV-1 izolatları tarafından kullanılmaktadır. Gerçekten de makrofajlar HIV enfeksiyonunun birçok kritik yönü açısından kilit bir rol oynamaktadır. HIV tarafından enfekte edilen ilk hücreler ve belki de hastada CD4+ hücreleri tükendiğinde HIV üretiminin kaynağı olarak görünmektedirler. Makrofajlar ve mikroglial hücreler, merkezi sinir sisteminde HIV tarafından enfekte edilen hücrelerdir. HIV ile enfekte hastaların bademcik ve geniz etlerinde makrofajlar birleşerek çok miktarda virüs üreten çok çekirdekli dev hücrelere dönüşür. ⓘ
HIV-1'in T-tropik suşları veya sinsitya indükleyici suşlar (SI; artık X4 virüsleri olarak adlandırılmaktadır) makrofajların yanı sıra birincil CD4+ T hücrelerinde de çoğalır ve giriş için α-kemokin reseptörü CXCR4'ü kullanır. ⓘ
Dual-tropik HIV-1 suşlarının HIV-1'in geçiş suşları olduğu ve dolayısıyla viral giriş için hem CCR5 hem de CXCR4'ü ortak reseptör olarak kullanabildiği düşünülmektedir. ⓘ
CXCR4 için bir ligand olan α-kemokin SDF-1, T-tropik HIV-1 izolatlarının replikasyonunu baskılar. Bunu, HIV hedef hücrelerinin yüzeyindeki CXCR4 ifadesini aşağı doğru düzenleyerek yapar. Sadece CCR5 reseptörünü kullanan M-tropik HIV-1 izolatları R5 olarak adlandırılır; sadece CXCR4 kullananlar X4 ve her ikisini birden kullananlar X4R5 olarak adlandırılır. Ancak, ko-reseptörlerin kullanımı tek başına viral tropizmi açıklamaz, çünkü tüm R5 virüsleri üretken bir enfeksiyon için makrofajlardaki CCR5'i kullanamaz ve HIV, muhtemelen CD4+ T hücre sayıları aşırı düşük seviyelere indiğinde enfeksiyonu sürdüren bir rezervuar oluşturan miyeloid dendritik hücrelerin bir alt tipini de enfekte edebilir. ⓘ
Bazı insanlar belirli HIV türlerine karşı dirençlidir. Örneğin, CCR5-Δ32 mutasyonuna sahip kişiler R5 virüsünün enfeksiyonuna karşı dirençlidir, çünkü mutasyon HIV'in bu yardımcı reseptöre bağlanamamasına neden olarak hedef hücreleri enfekte etme kabiliyetini azaltır. ⓘ
Cinsel ilişki HIV'in başlıca bulaşma yoludur. Hem X4 hem de R5 HIV seminal sıvıda bulunur ve bu da virüsün bir erkekten cinsel partnerine bulaşmasını sağlar. Virionlar daha sonra çok sayıda hücresel hedefi enfekte edebilir ve tüm organizmaya yayılabilir. Ancak bir seçilim süreci, bu yolla ağırlıklı olarak R5 virüsünün bulaşmasına yol açmaktadır. Alt tip B HIV-1 ile enfekte olan hastalarda, hastalığın geç evresinde sıklıkla bir eş reseptör değişimi ve CXCR4 aracılığıyla çeşitli T hücrelerini enfekte edebilen T-tropik varyantlar görülür. Bu varyantlar daha sonra, hızlı T hücresi tükenmesine, bağışıklık sisteminin çökmesine ve AIDS'in ortaya çıkışına işaret eden fırsatçı enfeksiyonlara neden olan yüksek virülans ile daha agresif bir şekilde çoğalır. HIV-pozitif hastalar, HAART tedavilerinin başlangıcından önce özellikle sorunlu olan son derece geniş bir fırsatçı enfeksiyon yelpazesi edinirler; ancak antiretroviral tedavilerin başlangıcından sonra ölüm sonrası incelenen HIV ile enfekte hastalar arasında da aynı enfeksiyonlar rapor edilmektedir. Dolayısıyla, enfeksiyonun seyri sırasında, CCR5 yerine CXCR4 kullanımına viral adaptasyon, AIDS'e ilerlemede önemli bir adım olabilir. Alt tip B ile enfekte bireylerle yapılan bir dizi çalışma, AIDS hastalarının yüzde 40 ila 50'sinin SI ve tahminen X4 fenotiplerine sahip virüsleri barındırabileceğini belirlemiştir. ⓘ
HIV-2, HIV-1'den çok daha az patojeniktir ve dünya çapındaki dağılımı Batı Afrika ile sınırlıdır. HIV-2'nin "aksesuar genleri" benimsemesi ve daha karışık eş reseptör kullanım modeli (CD4'ten bağımsızlık dahil), konak hücrelerde bulunan doğuştan gelen kısıtlama faktörlerinden kaçınmak için virüse adaptasyonunda yardımcı olabilir. Bulaşmayı ve üretken enfeksiyonu mümkün kılmak için normal hücresel mekanizmaları kullanmaya yönelik adaptasyon da insanlarda HIV-2 replikasyonunun yerleşmesine yardımcı olmuştur. Herhangi bir enfeksiyöz ajan için hayatta kalma stratejisi, konakçısını öldürmek değil, nihayetinde kommensal bir organizma haline gelmektir. Düşük bir patojenite elde edildikten sonra, zaman içinde bulaşmada daha başarılı olan varyantlar seçilecektir. ⓘ
Çoğalma döngüsü

Hücreye giriş

HIV virionu makrofajlara ve CD4+ T hücrelerine, yüzeyindeki glikoproteinlerin hedef hücredeki reseptörlere adsorpsiyonu ve ardından viral zarfın hedef hücre membranı ile füzyonu ve HIV kapsidinin hücre içine salınması yoluyla girer. ⓘ
Hücreye giriş, HIV viral zarfındaki trimerik zarf kompleksi (gp160 spike) ile hedef hücre yüzeyindeki hem CD4 hem de bir kemokin eş reseptörünün (genellikle CCR5 veya CXCR4, ancak diğerlerinin de etkileşime girdiği bilinmektedir) etkileşimi yoluyla başlar. Gp120, HIV-1'in etkili bir şekilde hücreden hücreye yayılmasını kolaylaştıran virolojik sinapsların kurulmasında rol oynayan merkezi integrin olan LFA-1'i aktive eden α4β7 integrinine bağlanır. Gp160 spike hem CD4 hem de kemokin reseptörleri için bağlanma alanları içerir. ⓘ
Füzyondaki ilk adım, gp120'nin CD4 bağlayıcı alanlarının CD4'e yüksek afiniteli bağlanmasını içerir. Gp120, CD4 proteinine bağlandıktan sonra zarf kompleksi yapısal bir değişikliğe uğrayarak gp120'nin kemokin reseptörü bağlama alanlarını açığa çıkarır ve hedef kemokin reseptörü ile etkileşime girmelerini sağlar. Bu, N-terminal füzyon peptidi gp41'in hücre membranına nüfuz etmesini sağlayan daha istikrarlı iki uçlu bir bağlantıya izin verir. Daha sonra gp41, HR1 ve HR2'deki tekrar dizileri etkileşime girerek gp41'in hücre dışı kısmının bir saç tokası şeklinde çökmesine neden olur. Bu döngü yapısı virüs ve hücre zarlarını birbirine yaklaştırarak zarların kaynaşmasına ve ardından viral kapsidin girişine izin verir. ⓘ
HIV hedef hücreye bağlandıktan sonra, HIV RNA'sı ve ters transkriptaz, integraz, ribonükleaz ve proteaz gibi çeşitli enzimler hücre içine enjekte edilir. Mikrotübül bazlı çekirdeğe taşınma sırasında viral tek sarmallı RNA genomu çift sarmallı DNA'ya dönüştürülür ve daha sonra bir konak kromozomuna entegre edilir. ⓘ
HIV, dendritik hücreleri (DC'ler) bu CD4-CCR5 yolu ile enfekte edebilir, ancak DC-SIGN gibi mannoz spesifik C-tipi lektin reseptörlerini kullanan başka bir yol da kullanılabilir. DC'ler, cinsel iletim sırasında virüsün karşılaştığı ilk hücrelerden biridir. Şu anda virüs DC'ler tarafından mukozada yakalandığında HIV'i T hücrelerine ileterek önemli bir rol oynadıkları düşünülmektedir. Nöronlarda doğal olarak bulunan FEZ-1'in varlığının, hücrelerin HIV tarafından enfekte edilmesini önlediğine inanılmaktadır. ⓘ

HIV-1 girişinin ve diğer birçok retrovirüsün girişinin uzun zamandır sadece plazma membranında gerçekleştiğine inanılmaktadır. Ancak son zamanlarda, HIV-1'in pH'dan bağımsız, klatrin aracılı endositozu ile üretken enfeksiyon da bildirilmiş ve yakın zamanda üretken girişin tek yolunu oluşturduğu öne sürülmüştür. ⓘ
Replikasyon ve transkripsiyon

Viral kapsidin hücreye girmesinden kısa bir süre sonra, ters transkriptaz adı verilen bir enzim, pozitif anlamlı tek sarmallı RNA genomunu bağlı viral proteinlerden kurtarır ve onu tamamlayıcı bir DNA (cDNA) molekülüne kopyalar. Ters transkripsiyon süreci son derece hataya açıktır ve ortaya çıkan mutasyonlar ilaç direncine neden olabilir veya virüsün vücudun bağışıklık sisteminden kaçmasına izin verebilir. Ters transkriptaz ayrıca cDNA sentezi sırasında viral RNA'yı parçalayan ribonükleaz aktivitesine ve antisens cDNA'dan bir duyu DNA'sı oluşturan DNA'ya bağımlı DNA polimeraz aktivitesine sahiptir. Birlikte, cDNA ve tamamlayıcısı, daha sonra hücre çekirdeğine taşınan çift sarmallı bir viral DNA oluşturur. Viral DNA'nın konak hücrenin genomuna entegrasyonu, integraz adı verilen başka bir viral enzim tarafından gerçekleştirilir. ⓘ
Entegre viral DNA daha sonra HIV enfeksiyonunun latent aşamasında uykuda kalabilir. Virüsün aktif olarak üretilebilmesi için bazı hücresel transkripsiyon faktörlerinin mevcut olması gerekir; bunlardan en önemlisi NF-κB'dir (nükleer faktör kappa B) ve T hücreleri aktive olduğunda bu faktör yukarı doğru düzenlenir. Bu, HIV tarafından hedef alınması, girilmesi ve ardından öldürülmesi en muhtemel hücrelerin enfeksiyonla aktif olarak savaşan hücreler olduğu anlamına gelir. ⓘ
Viral replikasyon sırasında, entegre DNA provirüsü RNA'ya transkribe edilir. Tam uzunluktaki genomik RNA'lar (gRNA) psödodiploid formda yeni viral partiküller halinde paketlenebilir. Paketlemedeki seçicilik, gRNA'nın dimerik konformerinin yapısal özellikleri ile açıklanmaktadır. gRNA dimeri, gRNA monomeri içinde, sırasıyla splicing ve translasyondan sorumlu SD ve AUG saç tokalarının sekestre edildiği ve DIS (dimerizasyon başlatma sinyali) saç tokasının açığa çıktığı tandem üç yönlü bir bağlantı ile karakterize edilir. gRNA dimerinin oluşumuna, gRNA monomerlerinin DIS saç tokası döngüleri arasındaki bir 'öpüşme' etkileşimi aracılık eder. Aynı zamanda, gRNA'daki belirli guanozin kalıntıları nükleokapsid (NC) proteininin bağlanması için uygun hale getirilir ve bu da müteakip virion birleşmesine yol açar. Kararsız gRNA dimerinin NC bağlanmasını takiben, gRNA'nın hem DIS hem de U5:AUG bölgelerinin kapsamlı baz eşleşmesine katıldığı daha kararlı bir konformasyona ulaştığı da bildirilmiştir. ⓘ
RNA ayrıca olgun mesajcı RNA'lar (mRNA'lar) üretmek için de işlenebilir. Çoğu durumda bu işlem, tam uzunluktaki genomdan daha kısa mRNA'lar üretmek için RNA eklemeyi içerir. RNA ekleme sırasında RNA'nın hangi kısmının çıkarılacağı, HIV protein kodlayan dizilerden hangisinin çevrileceğini belirler. ⓘ
Olgun HIV mRNA'ları çekirdekten sitoplazmaya aktarılır ve burada Rev de dahil olmak üzere HIV proteinlerini üretmek üzere çevrilir. Yeni üretilen Rev proteini üretildikçe çekirdeğe hareket eder ve burada virüs RNA'larının tam uzunlukta, eklenmemiş kopyalarına bağlanarak çekirdeği terk etmelerini sağlar. Bu tam uzunluktaki RNA'ların bazıları, yapısal proteinler Gag ve Env'yi üretmek için çevrilen mRNA'lar olarak işlev görür. Gag proteinleri virüs RNA genomunun kopyalarına bağlanarak onları yeni virüs partikülleri halinde paketler. HIV-1 ve HIV-2'nin RNA'larını farklı şekilde paketledikleri görülmektedir. HIV-1 herhangi bir uygun RNA'ya bağlanacaktır. HIV-2 tercihen Gag proteininin kendisini oluşturmak için kullanılan mRNA'ya bağlanır. ⓘ
Rekombinasyon
Her HIV-1 partikülünde iki RNA genomu kapsüllenmiştir (bkz. HIV'in yapısı ve genomu). Ters transkriptaz tarafından katalize edilen enfeksiyon ve replikasyon üzerine, iki genom arasında rekombinasyon meydana gelebilir. Rekombinasyon, tek sarmallı, pozitif anlamlı RNA genomlarının DNA oluşturmak üzere ters transkripsiyona uğramasıyla gerçekleşir. Ters transkripsiyon sırasında, yeni oluşan DNA, viral RNA'nın iki kopyası arasında birden çok kez geçiş yapabilir. Bu rekombinasyon şekli kopya seçimi olarak bilinir. Rekombinasyon olayları genom boyunca meydana gelebilir. Her replikasyon döngüsünde genom başına iki ila 20 rekombinasyon olayı meydana gelebilir ve bu olaylar ebeveynden yavru genomlara aktarılan genetik bilgiyi hızla karıştırabilir. ⓘ
Viral rekombinasyon, muhtemelen anti-retroviral tedaviye karşı direncin evrimine katkıda bulunan genetik varyasyon üretir. Rekombinasyon, prensipte, konağın bağışıklık savunmasının üstesinden gelinmesine de katkıda bulunabilir. Bununla birlikte, genetik çeşitliliğin adaptif avantajlarının gerçekleşmesi için, her bir enfekte eden virüs partikülünde paketlenen iki viral genomun, farklı genetik yapıya sahip ayrı ata ebeveyn virüslerden ortaya çıkmış olması gerekir. Bu tür karışık paketlemenin doğal koşullar altında ne sıklıkla meydana geldiği bilinmemektedir. ⓘ
Bonhoeffer ve arkadaşları, ters transkriptaz tarafından şablon değiştirmenin tek sarmallı RNA genomundaki kırılmalarla başa çıkmak için bir onarım süreci olarak hareket ettiğini öne sürmüştür. Buna ek olarak, Hu ve Temin rekombinasyonun RNA genomlarındaki hasarın onarımı için bir adaptasyon olduğunu öne sürmüştür. Ters transkriptaz ile iplik değiştirme (kopya seçimi rekombinasyonu), iki hasarlı tek iplikli RNA genom kopyasından hasarsız bir genomik DNA kopyası oluşturabilir. HIV'de rekombinasyonun adaptif faydasına ilişkin bu görüş, her HIV partikülünün neden bir yerine iki tam genom içerdiğini açıklayabilir. Ayrıca, rekombinasyonun bir onarım süreci olduğu görüşü, onarım yararının her replikasyon döngüsünde gerçekleşebileceğini ve bu yararın iki genom genetik olarak farklı olsa da olmasa da gerçekleşebileceğini ima eder. HIV'de rekombinasyonun bir onarım süreci olduğu görüşüne göre, rekombinasyonel varyasyonun oluşması, şablon değiştirmenin evriminin nedeni değil, bir sonucu olacaktır. ⓘ
HIV-1 enfeksiyonu kronik enflamasyona ve reaktif oksijen türlerinin üretimine neden olur. Bu nedenle HIV genomu, tek sarmallı RNA'daki kırılmalar da dahil olmak üzere oksidatif hasara karşı savunmasız olabilir. HIV için olduğu kadar genel olarak virüsler için de başarılı enfeksiyon, genellikle genoma zarar veren reaktif oksijen türlerinin üretimini içeren konakçı savunma stratejilerinin üstesinden gelmeye bağlıdır. Bu nedenle, Michod ve arkadaşları virüsler tarafından rekombinasyonun genom hasarının onarımı için bir adaptasyon olduğunu ve rekombinasyonel varyasyonun ayrı bir fayda sağlayabilecek bir yan ürün olduğunu öne sürmüştür. ⓘ
Birleşme ve salım

Viral döngünün son adımı olan yeni HIV-1 viryonlarının bir araya gelmesi konak hücrenin plazma membranında başlar. Env poliproteini (gp160) endoplazmik retikulumdan geçerek Golgi aparatına taşınır ve burada furin tarafından parçalanarak iki HIV zarf glikoproteini olan gp41 ve gp120 oluşur. Bunlar konak hücrenin plazma membranına taşınır ve burada gp41, gp120'yi enfekte hücrenin membranına bağlar. Gag (p55) ve Gag-Pol (p160) poliproteinleri de HIV genomik RNA ile birlikte plazma membranının iç yüzeyi ile birleşir ve oluşan virion konak hücreden tomurcuklanmaya başlar. Gag poliproteinlerinin hala gerçek matriks, kapsid ve nükleokapsid proteinlerine bölünmesi gerektiğinden, tomurcuklanan virion hala olgunlaşmamıştır. Bu bölünmeye paketlenmiş viral proteaz aracılık eder ve proteaz inhibitörü sınıfındaki antiretroviral ilaçlar tarafından inhibe edilebilir. Çeşitli yapısal bileşenler daha sonra olgun bir HIV virionu üretmek üzere bir araya gelir. Yalnızca olgun virionlar başka bir hücreyi enfekte edebilir. ⓘ
Vücut içinde yayılma

Bir hücrenin bir virion tarafından enfekte edilmesine ilişkin klasik süreç, "hücreden hücreye yayılma" olarak adlandırılan ve daha yakın zamanda tanınan bir süreçten ayırt etmek için "hücresiz yayılma" olarak adlandırılabilir. Hücresiz yayılımda (şekle bakınız), virüs partikülleri enfekte olmuş bir T hücresinden tomurcuklanır, kana veya hücre dışı sıvıya karışır ve tesadüfi bir karşılaşmanın ardından başka bir T hücresini enfekte eder. HIV ayrıca, iki yolun tanımlandığı hücreden hücreye yayılma süreciyle bir hücreden diğerine doğrudan bulaşma yoluyla da yayılabilir. İlk olarak, enfekte olmuş bir T hücresi virüsü virolojik bir sinaps yoluyla doğrudan hedef T hücresine aktarabilir. İkinci olarak, makrofaj veya dendritik hücre gibi antijen sunan bir hücre (APC), üretken enfeksiyonu (makrofajlar söz konusu olduğunda) veya viryonların trans halinde yakalanmasını ve aktarılmasını (dendritik hücreler söz konusu olduğunda) içeren bir süreçle HIV'i T hücrelerine iletebilir. Hangi yol kullanılırsa kullanılsın, hücreden hücreye aktarım yoluyla enfeksiyonun hücresiz virüs yayılımından çok daha etkili olduğu bildirilmektedir. Hücreden hücreye temas bölgesine doğru polarize virüs tomurcuklanması, viryonların sıvı faz difüzyonunu en aza indiren hücrelerin yakın yerleşimi ve hedef hücre üzerindeki HIV giriş reseptörlerinin temas bölgesine doğru kümelenmesi gibi bir dizi faktör bu artan verimliliğe katkıda bulunmaktadır. Hücreden hücreye yayılmanın özellikle CD4+ T hücrelerinin yoğun olarak bulunduğu ve sıklıkla etkileşime girdiği lenfoid dokularda önemli olduğu düşünülmektedir. İntravital görüntüleme çalışmaları, in vivo HIV virolojik sinaps kavramını desteklemiştir. HIV için mevcut olan birçok yayılma mekanizması, anti-retroviral tedavilere rağmen virüsün devam eden replikasyonuna katkıda bulunmaktadır. ⓘ
Genetik değişkenlik

HIV, çok yüksek genetik değişkenliğe sahip olmasıyla birçok virüsten ayrılır. Bu çeşitlilik, her gün yaklaşık 1010 viryonun üretildiği hızlı replikasyon döngüsünün, replikasyon döngüsü başına nükleotid bazı başına yaklaşık 3 x 10-5 gibi yüksek bir mutasyon oranının ve ters transkriptazın rekombinojenik özelliklerinin bir sonucudur. ⓘ
Bu karmaşık senaryo, enfekte olmuş tek bir hastada bir gün içinde çok sayıda HIV varyantının oluşmasına yol açmaktadır. Bu değişkenlik, tek bir hücre aynı anda iki veya daha fazla farklı HIV suşu tarafından enfekte edildiğinde daha da artar. Eşzamanlı enfeksiyon gerçekleştiğinde, yavru viryonların genomu iki farklı suştan gelen RNA ipliklerinden oluşabilir. Bu hibrit virion daha sonra replikasyona uğrayacağı yeni bir hücreyi enfekte eder. Bu gerçekleşirken, ters transkriptaz, iki farklı RNA şablonu arasında gidip gelerek, iki ebeveyn genomu arasında rekombinant olan yeni sentezlenmiş bir retroviral DNA dizisi oluşturacaktır. Bu rekombinasyon en çok alt tipler arasında meydana geldiğinde belirgindir. ⓘ
Yakından ilişkili simian immün yetmezlik virüsü (SIV), doğal konakçı türlerine göre sınıflandırılan birçok suşa dönüşmüştür. Afrika yeşil maymunu (SIVagm) ve isli mangabey (SIVsmm) SIV suşlarının konakçılarıyla uzun bir evrimsel geçmişe sahip olduğu düşünülmektedir. Bu konakçılar, konakçının kanında yüksek seviyelerde bulunan, ancak yalnızca hafif bir bağışıklık tepkisi uyandıran, simian AIDS'in gelişmesine neden olmayan ve insanlarda HIV enfeksiyonunun tipik özelliği olan kapsamlı mutasyon ve rekombinasyona uğramayan virüsün varlığına uyum sağlamışlardır. ⓘ
Buna karşılık, bu suşlar SIV'e adapte olmamış türleri ("heterolog" veya rhesus veya cynomologus makakları gibi benzer konaklar) enfekte ettiğinde, hayvanlarda AIDS gelişir ve virüs, insan HIV enfeksiyonunda görülene benzer genetik çeşitlilik oluşturur. HIV-1'in en yakın genetik akrabası olan şempanze SIV (SIVcpz), doğal konakçısında artan ölüm oranı ve AIDS benzeri semptomlarla ilişkilidir. SIVcpz, şempanze ve insan popülasyonlarına nispeten yakın zamanda bulaşmış gibi görünmektedir, bu nedenle konakçıları henüz virüse adapte olmamıştır. Bu virüs ayrıca çoğu SIV'de bulunan nef geninin bir işlevini kaybetmiştir. Patojenik olmayan SIV varyantları için nef, CD3 markörü aracılığıyla T hücresi aktivasyonunu baskılar. Nef'in patojenik olmayan SIV formlarındaki işlevi, enflamatuar sitokinlerin, MHC-1'in ve T hücresi trafiğini etkileyen sinyallerin ekspresyonunu azaltmaktır. HIV-1 ve SIVcpz'de nef, T hücresi aktivasyonunu inhibe etmez ve bu işlevini kaybetmiştir. Bu işlev olmadan, T hücresi tükenmesi daha olasıdır ve immün yetmezliğe yol açar. ⓘ
Zarf (env) bölgesindeki farklılıklar temelinde üç HIV-1 grubu tanımlanmıştır: M, N ve O. M grubu en yaygın olanıdır ve tüm genoma dayalı olarak coğrafi olarak farklı sekiz alt tipe (veya klasta) ayrılır. En yaygın olanları B (çoğunlukla Kuzey Amerika ve Avrupa'da bulunur), A ve D (çoğunlukla Afrika'da bulunur) ve C (çoğunlukla Afrika ve Asya'da bulunur) alt tipleridir; bu alt tipler filogenetik ağaçta HIV-1'in M grubunun soyunu temsil eden dalları oluşturur. Farklı alt tiplerle birlikte enfeksiyon, dolaşımdaki rekombinant formların (CRF'ler) ortaya çıkmasına neden olur. Küresel alt tip yaygınlığı analizinin yapıldığı son yıl olan 2000'de, dünya çapındaki enfeksiyonların %47,2'si alt tip C, %26,7'si alt tip A/CRF02_AG, %12,3'ü alt tip B, %5,3'ü alt tip D, %3,2'si CRF_AE ve kalan %5,3'ü diğer alt tipler ve CRF'lerden oluşmaktaydı. HIV-1 araştırmalarının çoğu B alt tipine odaklanmıştır; az sayıda laboratuvar diğer alt tiplere odaklanmaktadır. Dördüncü bir grup olan "P "nin varlığı, 2009 yılında izole edilen bir virüse dayanılarak varsayılmıştır. Bu türün, ilk kez 2006 yılında batı ova gorillerinden izole edilen goril SIV'sinden (SIVgor) türediği anlaşılmaktadır. ⓘ
HIV-2'nin en yakın akrabası, isli mangabelerde bulunan bir SIV türü olan SIVsm'dir. HIV-1 SIVcpz'den, HIV-2 ise SIVsm'den türetildiğinden, HIV-2'nin genetik dizilimi HIV-1 ile yalnızca kısmen homologdur ve SIVsm'ninkine daha çok benzemektedir. ⓘ
Teşhis

Birçok HIV pozitif kişi virüsle enfekte olduklarının farkında değildir. Örneğin, 2001 yılında Afrika'da cinsel olarak aktif kentsel nüfusun %1'inden azı test yaptırmıştır ve bu oran kırsal nüfus için daha da düşüktür. Ayrıca, 2001 yılında kentsel sağlık tesislerine giden hamile kadınların sadece %0,5'i danışmanlık almış, test yaptırmış veya test sonuçlarını almıştır. Yine bu oran kırsal kesimdeki sağlık tesislerinde daha da düşüktür. Donörler bu nedenle enfeksiyondan habersiz olabileceğinden, tıpta ve tıbbi araştırmalarda kullanılan donör kan ve kan ürünleri rutin olarak HIV taramasından geçirilmektedir. ⓘ
HIV-1 testi başlangıçta HIV-1'e karşı antikorları tespit etmek için enzime bağlı immünosorbent tahlili (ELISA) kullanılarak yapılır. İlk ELISA sonucu reaktif olmayan numuneler, enfekte bir partnere veya HIV statüsü bilinmeyen bir partnere yeni bir maruziyet olmadığı sürece HIV-negatif olarak kabul edilir. ELISA sonucu reaktif olan numuneler çift olarak tekrar test edilir. Tekrarlanan testlerden birinin sonucu reaktif çıkarsa, numune tekrar tekrar reaktif olarak rapor edilir ve daha spesifik bir ek testle (örn. polimeraz zincir reaksiyonu (PCR), western blot veya daha az yaygın olarak immünofloresan testi (IFA)) doğrulama testine tabi tutulur. Yalnızca ELISA ile tekrar tekrar reaktif olan ve IFA veya PCR ile pozitif olan veya western blot ile reaktif olan örnekler HIV pozitif olarak kabul edilir ve HIV enfeksiyonunun göstergesidir. ELISA ile tekrar tekrar reaktif olan numuneler bazen belirsiz bir western blot sonucu verir; bu da enfekte bir kişide HIV'e karşı tamamlanmamış bir antikor yanıtı veya enfekte olmayan bir kişide spesifik olmayan reaksiyonlar olabilir. ⓘ
Bu belirsiz vakalarda enfeksiyonu doğrulamak için IFA kullanılabilse de, bu test yaygın olarak kullanılmamaktadır. Genel olarak, western blot sonuçları belirsiz olan kişiler için bir aydan daha uzun bir süre sonra ikinci bir numune alınmalı ve yeniden test edilmelidir. Çok daha az yaygın olmasına rağmen, nükleik asit testi (örn. viral RNA veya proviral DNA amplifikasyon yöntemi) de belirli durumlarda tanıya yardımcı olabilir. Buna ek olarak, test edilen birkaç numune, düşük miktarda numune nedeniyle kesin olmayan sonuçlar verebilir. Bu durumlarda, ikinci bir numune toplanır ve HIV enfeksiyonu açısından test edilir. ⓘ
Modern HIV testi, pencere dönemi dikkate alındığında son derece doğrudur. Tek bir tarama testi zamanın %99'undan fazlasında doğru sonuç verir. Standart iki aşamalı test protokolünde yanlış pozitif sonuç olasılığının düşük riskli bir popülasyonda yaklaşık 250.000'de 1 olduğu tahmin edilmektedir. Maruziyet sonrası testlerin hemen ve ardından altı hafta, üç ay ve altı ayda bir yapılması önerilmektedir. ⓘ
ABD Hastalık Kontrol ve Önleme Merkezlerinin (CDC) en son tavsiyelerine göre HIV testi, HIV-1 ve HIV-2 antikorları ve p24 antijeni için immünoassay kombinasyon testi ile başlamalıdır. Negatif bir sonuç HIV maruziyetini dışlarken, pozitif bir sonucu hangi antikorların mevcut olduğunu tespit etmek için HIV-1/2 antikor farklılaştırma immunoassay'i takip etmelidir. Bu da dört olası senaryoya yol açmaktadır:
- 1. HIV-1 (+) & HIV-2 (-): HIV-1 antikorları tespit edildi
- 2. HIV-1 (-) & HIV-2 (+): HIV-2 antikorları tespit edildi
- 3. HIV-1 (+) & HIV-2 (+): hem HIV-1 hem de HIV-2 antikorları tespit edildi
- 4. HIV-1 (-) veya belirsiz & HIV-2 (-): HIV-1'in akut enfeksiyonunu veya yokluğunu tespit etmek için nükleik asit testi yapılmalıdır. ⓘ
Araştırma
HIV/AIDS araştırmaları, HIV/AIDS'i önlemeye, tedavi etmeye veya iyileştirmeye çalışan tüm tıbbi araştırmaların yanı sıra bulaşıcı bir ajan olarak HIV'in ve HIV'in neden olduğu hastalık olarak AIDS'in doğası hakkındaki temel araştırmaları da içerir. ⓘ
Birçok hükümet ve araştırma kurumu HIV/AIDS araştırmalarına katılmaktadır. Bu araştırmalar, cinsel eğitim araştırmaları gibi davranışsal sağlık müdahalelerini ve cinsel yolla bulaşan hastalıklar için mikrobisit araştırmaları, HIV aşıları ve anti-retroviral ilaçlar gibi ilaç geliştirme çalışmalarını içermektedir. Diğer tıbbi araştırma alanları arasında maruziyet öncesi profilaksi, maruziyet sonrası profilaksi, sünnet ve HIV ve hızlandırılmış yaşlanma etkileri konuları yer almaktadır. ⓘ
Tedavi ve bulaşma
HIV/AIDS'in tedavisi normalde çoklu antiretroviral ilaçların kullanımını içerir. Dünyanın birçok yerinde HIV, AIDS'e ilerlemenin giderek daha nadir görüldüğü kronik bir durum haline gelmiştir. ⓘ
HIV latansı ve bunun sonucu olarak CD4+ T hücreleri, dendritik hücreler ve makrofajlardaki viral rezervuar, virüsün eradikasyonunun önündeki ana engeldir. ⓘ
HIV son derece öldürücü olmasına rağmen, HIV pozitif bir kişi anti-retroviral tedavi nedeniyle sürekli olarak tespit edilemeyen viral yüke (<50 kopya/ml) sahip olduğunda cinsel ilişki yoluyla bulaşmanın gerçekleşmediğini belirtmek önemlidir. Bu durum ilk olarak 2008 yılında İsviçre Federal AIDS/HIV Komisyonu tarafından İsviçre Bildirisi'nde savunulmuş, ancak bu bildiri o dönemde tartışmalara yol açmıştır. Bununla birlikte, çok sayıda araştırmanın ardından, HIV pozitif kişinin viral yükünün sürekli olarak tespit edilemediği durumlarda, HIV'in cinsel yolla bulaşma olasılığının sıfır olduğu anlaşılmıştır; bu U=U, "Tespit Edilemez = Bulaşmaz" olarak bilinir ve "bulaştıramaz" olarak da ifade edilir. U=U'yu gösteren çalışmalar şunlardır: Opposites Attract, PARTNER 1, PARTNER 2 (erkek-erkek çiftler için) ve HPTN052 (heteroseksüel çiftler için) "HIV ile yaşayan partnerin kalıcı olarak baskılanmış viral yüke sahip olduğu" durumlardır. Bu çalışmalarda, bir partnerin HIV pozitif ve bir partnerin HIV negatif olduğu çiftler kaydedilmiş ve düzenli HIV testleri tamamlanmıştır. Dört çalışmada toplamda, dört kıtada 4097 çift kaydedilmiş ve 151.880 kondomsuz seks eylemi rapor edilmiştir; pozitif partnerin tespit edilemeyen viral yüke sahip olduğu filogenetik olarak bağlantılı sıfır HIV bulaşması olmuştur. Bunu takiben, "sıfır risk" kullanımını savunan U=U uzlaşı bildirisi, ABD CDC, İngiliz HIV Derneği ve Lancet tıp dergisi de dahil olmak üzere yüzlerce kişi ve kuruluş tarafından imzalanmıştır. PARTNER 2 çalışmasının nihai sonuçlarının önemi Terrence Higgins Trust'ın tıbbi direktörü tarafından "abartılması imkansız" olarak tanımlanırken, başyazar Alison Rodger "tespit edilemeyen viral yükün HIV'i bulaşmaz hale getirdiği ... HIV bulaşmasını önleyerek HIV pandemisini sona erdirmeye yardımcı olabileceği" mesajını verdi. Yazarlar bulgularını The Lancet'te şu şekilde özetlemişlerdir:
Sonuçlarımız, eşcinsel erkekler için viral baskılanma ve HIV bulaşma riski konusunda daha önce heteroseksüel çiftler için elde edilenlere benzer düzeyde kanıt sağlamakta ve HIV viral yükü baskılandığında eşcinsel çiftlerde kondomsuz seks yoluyla HIV bulaşma riskinin etkin bir şekilde sıfır olduğunu göstermektedir. Bulgularımız U=U (tespit edilemeyen eşittir bulaşmayan) kampanyasının mesajını ve HIV için erken test ve tedavinin faydalarını desteklemektedir.
Bu sonuç, ABD Ulusal Sağlık Enstitüleri Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü Direktörü Anthony S. Fauci ve ekibi tarafından Journal of the American Medical Association'da yayınlanan bir görüşte ortaya konan, U=U'nun tespit edilemeyen viral yük korunduğunda etkili bir HIV önleme yöntemi olduğu sonucuyla tutarlıdır. ⓘ
Genital herpes (HSV-2) virüsü ile enfekte olan kişilerde genital cildin submukozasında inflamatuar dendritik hücrelerin yanı sıra CCR-5 ile zenginleştirilmiş CD4+ T hücrelerinde ilişkili bir artış vardır. HIV'in CCR-5 pozitif hücreler için tropizmi, genital herpesli kişiler arasında HIV edinimindeki iki ila üç kat artışı açıklamaktadır. Günlük antiviral (örn. asiklovir) ilaçlar subklinik post reaktivasyon inflamasyonunu azaltmaz ve bu nedenle HIV edinimi riskini azaltmaz. ⓘ
Tarihçe
Keşif
"Egzotik yeni bir hastalık" hakkındaki ilk haber 18 Mayıs 1981'de New York Native adlı eşcinsel gazetesinde yayınlandı. ⓘ
AIDS klinik olarak ilk kez 1981 yılında Amerika Birleşik Devletleri'nde gözlendi. İlk vakalar, bağışıklık sistemi çok zayıflamış kişilerde ortaya çıktığı bilinen nadir bir fırsatçı enfeksiyon olan Pneumocystis pnömonisi (PCP veya PJP, bu son terim, etken maddenin artık Pneumocystis jirovecii olarak adlandırıldığını kabul etmektedir) semptomları gösteren, bağışıklığı bozan bilinen bir nedeni olmayan enjeksiyon uyuşturucu kullanıcıları ve eşcinsel erkeklerden oluşan bir kümeydi. Kısa bir süre sonra NYU Tıp Fakültesi'ndeki araştırmacılar, daha önce nadir görülen Kaposi sarkomu (KS) adlı bir cilt kanseri geliştiren eşcinsel erkekler üzerinde çalıştılar. Çok sayıda PJP ve KS vakasının ortaya çıkması, ABD Hastalık Kontrol ve Önleme Merkezlerini (CDC) alarma geçirdi ve salgını izlemek üzere bir CDC görev gücü oluşturuldu. Geriye dönük olarak tanımlanan en eski AIDS vakasının 1966'da Norveç'te görüldüğüne inanılmaktadır. ⓘ
Başlangıçta, CDC'nin hastalık için resmi bir adı yoktu, genellikle onunla ilişkili hastalıklar yoluyla atıfta bulunuyordu, örneğin, HIV'i keşfedenlerin virüsü ilk olarak adlandırdığı hastalık olan lenfadenopati. Ayrıca 1981 yılında bir görev gücünün kurulduğu Kaposi Sarkomu ve Fırsatçı Enfeksiyonlar adını da kullandılar. Genel basında, eşcinsellerle ilgili bağışıklık yetersizliği anlamına gelen GRID terimi ortaya atılmıştı. CDC, bir isim arayışı içinde ve enfekte olmuş topluluklara bakarak, eşcinselleri, eroin kullanıcılarını, hemofili hastalarını ve Haitilileri ayırıyor gibi göründüğü için "4H hastalığı "nı icat etti. Ancak AIDS'in sadece eşcinsel toplumuna özgü olmadığı belirlendikten sonra GRID teriminin yanıltıcı olduğu anlaşıldı ve Temmuz 1982'deki bir toplantıda AIDS tanıtıldı. Eylül 1982'de CDC AIDS adını kullanmaya başladı. ⓘ
1983 yılında Amerikalı Robert Gallo ve Fransız araştırmacılar Françoise Barré-Sinoussi ve Luc Montagnier liderliğindeki iki ayrı araştırma grubu birbirinden bağımsız olarak yeni bir retrovirüsün AIDS hastalarını enfekte ediyor olabileceğini açıkladı ve bulgularını Science dergisinin aynı sayısında yayınladı. Gallo, grubunun AIDS'li bir kişiden izole ettiği bir virüsün, kendi grubunun ilk izole ettiği diğer insan T-lenfotropik virüslerine (HTLV'ler) çarpıcı bir şekilde benzediğini iddia etti. Gallo 1987 yılında, 1984 yılında keşfettiğini iddia ettiği virüsün aslında bir yıl önce Fransa'dan kendisine gönderilen bir virüs olduğunu itiraf etti. Gallo'nun grubu yeni izole ettikleri virüse HTLV-III adını verdi. Montagnier'in grubu, birincil HIV enfeksiyonunun iki klasik belirtisi olan boyundaki lenf düğümlerinde şişme ve fiziksel güçsüzlükle başvuran bir hastadan bir virüs izole etti. Gallo'nun grubunun raporuyla çelişen Montagnier ve meslektaşları, bu virüsün çekirdek proteinlerinin HTLV-I'inkilerden immünolojik olarak farklı olduğunu gösterdi. Montagnier'in grubu izole ettikleri virüse lenfadenopati ile ilişkili virüs (LAV) adını verdi. Bu iki virüsün aynı olduğu ortaya çıkınca, 1986'da LAV ve HTLV-III HIV olarak yeniden adlandırıldı. ⓘ
Montagnier ve Gallo gruplarıyla eşzamanlı olarak çalışan bir başka grup da San Francisco'daki California Üniversitesi'nden Jay A. Levy'dir. Levy 1983 yılında bağımsız olarak AIDS virüsünü keşfetti ve bu virüse AIDS ile ilişkili retrovirüs (ARV) adını verdi. Bu virüs Montagnier ve Gallo grupları tarafından rapor edilen virüsten çok farklıydı. ARV suşları ilk kez HIV izolatlarının heterojenliğini gösterdi ve bunların birçoğu Amerika Birleşik Devletleri'nde bulunan AIDS virüsünün klasik örnekleri olarak kaldı. ⓘ
Kökenleri
Hem HIV-1 hem de HIV-2'nin Batı-Orta Afrika'daki insan olmayan primatlardan kaynaklandığına ve 20. yüzyılın başlarında insanlara geçtiğine (zoonoz olarak bilinen bir süreç) inanılmaktadır. ⓘ
HIV-1'in Kamerun'un güneyinde, vahşi şempanzeleri enfekte eden bir simian immün yetmezlik virüsü (SIV) olan SIVcpz'nin evrimi yoluyla ortaya çıktığı görülmektedir (HIV-1, Pan troglodytes troglodytes şempanze alt türünde endemik olan SIVcpz'den türemiştir). HIV-2'nin en yakın akrabası, Batı Afrika kıyılarında (Senegal'in güneyinden Fildişi Sahili'nin batısına kadar) yaşayan bir Eski Dünya maymunu olan isli mangabey (Cercocebus atys atys) virüsü olan SIVsmm'dir. Baykuş maymunu gibi Yeni Dünya maymunları, muhtemelen iki viral direnç geninin genomik füzyonu nedeniyle HIV-1 enfeksiyonuna dirençlidir. ⓘ
HIV-1'in en az üç ayrı durumda tür bariyerini aştığı ve virüsün üç grubu olan M, N ve O'nun ortaya çıkmasına neden olduğu düşünülmektedir. ⓘ

Avcı ya da çalı eti satıcısı olarak çalı eti faaliyetlerine katılan insanların yaygın olarak SIV kaptığına dair kanıtlar bulunmaktadır. Bununla birlikte, SIV zayıf bir virüstür ve tipik olarak enfeksiyondan sonraki haftalar içinde insan bağışıklık sistemi tarafından baskılanır. Virüsün HIV'e dönüşmesi için yeterli zamanın tanınması için virüsün bireyden bireye hızlı bir şekilde arka arkaya birkaç kez bulaşmasının gerekli olduğu düşünülmektedir. Ayrıca, kişiden kişiye bulaşma oranının nispeten düşük olması nedeniyle, ancak 20. yüzyıldan önce Afrika'da bulunmadığı düşünülen bir veya daha fazla yüksek riskli bulaşma kanalının varlığı halinde nüfusun tamamına yayılabilir. ⓘ
Virüsün insanlara adapte olmasını ve toplum genelinde yayılmasını sağlayan, önerilen spesifik yüksek riskli bulaşma kanalları, hayvandan insana geçişin önerilen zamanlamasına bağlıdır. Virüs üzerinde yapılan genetik çalışmalar, HIV-1 M grubunun en son ortak atasının 1910 civarına dayandığını göstermektedir. Bu tarihlendirmeyi savunanlar, HIV salgınını sömürgeciliğin ortaya çıkışı ve büyük sömürge Afrika şehirlerinin büyümesiyle ilişkilendirerek, farklı cinsel temas kalıpları (özellikle çoklu, eşzamanlı birliktelikler), fuhuşun yayılması ve yeni ortaya çıkan sömürge şehirlerinde genital ülser hastalıklarının (frengi gibi) yüksek sıklığı dahil olmak üzere sosyal değişikliklere yol açmıştır. Vajinal ilişki sırasında HIV bulaşma oranları tipik olarak düşük olsa da, partnerlerden birinde genital ülserle sonuçlanan cinsel yolla bulaşan bir enfeksiyon varsa bu oran kat kat artmaktadır. 1900'lerin başlarında sömürge şehirleri yüksek fuhuş ve genital ülser yaygınlığıyla dikkat çekiyordu. 1928 itibariyle doğu Leopoldville'de (şu anda Kinshasa) yaşayan kadınların %45'inin fahişe olduğu ve 1933 itibariyle aynı şehirde yaşayanların yaklaşık %15'inin frengi türlerinden biriyle enfekte olduğu düşünülüyordu. ⓘ
Bir insanda görülen ve iyi belgelenmiş en eski HIV vakası 1959 yılında Belçika Kongosu'nda görülmüştür. Virüs Amerika Birleşik Devletleri'nde 1960'ların ortalarından sonlarına kadar görülmüş olabilir; Robert Rayford adında on altı yaşında bir erkek 1966 yılında semptomlar göstermiş ve 1969 yılında ölmüştür. ⓘ
Alternatif ve muhtemelen tamamlayıcı bir hipotez, İkinci Dünya Savaşı'nı takip eden yıllarda Afrika'da, toplu aşılama, antibiyotik ve sıtma karşıtı tedavi kampanyaları sırasında tek kullanımlık şırıngaların steril olmayan şekilde yeniden kullanılması gibi güvenli olmayan tıbbi uygulamaların yaygın kullanımına işaret etmektedir. HIV-1 grupları M ve O ile HIV-2 grupları A ve B için en son ortak atanın zamanlaması üzerine yapılan araştırmalar, SIV'in yirminci yüzyıl boyunca bulaşıcı HIV soylarına yol açtığını göstermektedir. İnsanlara bu geçişlerin dağınık zamanlaması, HIV'in türler arası geçişini açıklamak için tek bir dış etkene ihtiyaç olmadığını ima etmektedir. Bu gözlem, HIV salgınlarının kökenine ilişkin iki yaygın görüşün her ikisiyle de tutarlıdır: Enfekte primatların kesilmesi veya doğranması sırasında insanlara SIV bulaşması ve Sahra altı Afrika şehirlerinin sömürgeci yayılımı. ⓘ
AIDS hastalığının Afrika’da maymunlardan insanlara geçtiği düşünülüyor. Bu virüsün orta Afrika’da şempanze avlayan insanlara bu esnada aldıkları yaralar vasıtasıyla veya sonrasında şempanze etiyle temas ettiklerinde geçmiş olabileceği iddia edilmekte. ⓘ
AIDS
AIDS (İngilizce: Acquired Immune Deficiency Syndrome/Türkçe: Sonradan Edinilen Bağışıklık Sistemi Yetersizliği Sendromu) anlamına gelir. Sonradan Edinilen ifadesi hastalığın irsi (genetik) olmadığı anlamına gelmektedir. Bağışıklık Sistemi Yetersizliği ifadesi ise vücudun bağışıklık sisteminin çökmesi anlamına gelmektedir. Sendrom kelimesi ise bir başka hastalıkla bağlantısı olabilecek çeşitli hastalıklar anlamına gelmektedir. ⓘ
HIV ile yaşayan kişi hastaymış gibi görünmeyebilir veya kişi kendini hasta hissetmeyebilir, HIV ile enfekte olduğunu bile bilmeyebilir. Çünkü, HIV ile enfekte olan kişilerde semptomların ortaya çıkmasına ve ölüme yol açan şey HIV'in kendisi değil, vücudun bağışıklık sisteminin çökmesiyle tamamen savunmasız kaldığı diğer enfeksiyonlardır. ⓘ
Virüsün yapısı
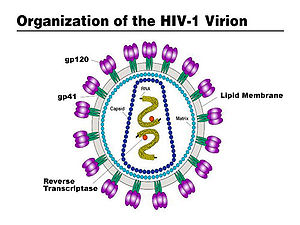
Virüs tek sarmallı RNA yı çevreleyen p24 proteinlerinden oluşan kapsit, bunun dışında küçük bir matriksi çevreleyen kılıftan oluşur. Kılıfta virüsün antijenik yapısını belirleyen glikoproteinler bulunur. ⓘ
HIV virüsünün üç glikoproteini vardır. Bunlar:
- gp160: Proteaz enzimi ile alt üniteleri olan gp120 ve gp41'e bölünerek iki ayrı glikoprotein oluşur. Bu proteinler virüsün membranında bulunurlar.
- gp41: HIV'in hücreye girmesini sağlar.
- gp120: HIV'in DNA'ya tutunmasını sağlar.
- LEDGF: HIV'in DNA'ya nasıl gireceğini belirler.[1] 3 Ocak 2015 tarihinde Wayback Machine sitesinde arşivlendi. ⓘ
Kronoloji
- İlk defa Leopoldville, Belçika Kongo'sunda yaşamış bir kişiden 1959 alınan kanda tespit edildi. O tarihten beri dolapta saklanan kanın, 1998'de geliştirilen HIV testi ile hastalığı taşıdığı onaylandı.
- Dünyayı dolaşmış, 1961'de Batı Afrika'da uzun yolculuk yapmış Norveçli bir gemici bağışıklık yetersizliği ile 1966 öldü. Karısı ve kızı da ertesi yıl aynı sebeple öldü.
- Danimarkalı bir cerrah olan Dr. Grethe Rath, Zaire'de bir seri enfeksiyon ve ender görülen Pneumocystis pneumonia (PCP) tanısı ile öldü.
- 1979-1981 arası, normalde çok ender görülen, 12 Kaposi Sarkomu'dan vakası tespit edildi.
- 1981'de Kaliforniya Üniversitesi'nde Pneumocystis carinii tanısı tedavi edilen bir eşcinsel hastada CD4 T hücrelerinin (yardımcı T hücreleri) eksikliği tespit edildi.
- 1982'de CDC hastalığa AIDS ismini verdi.
- 1983'te daha sonra HIV ismi verilecek olan retrovirüsten kaynakladığı bulundu.
- 1984'te HIV için ELISA testi geliştirildi. ⓘ
Bulaşma yolları Belirti ve Önlemler
HIV'iv enfekte olabilmesi için, virüsün dış ortam koşullarında bozulmayacağı kadar kısa bir süre içinde bir kişiden diğerine nakledilmesi gerekir. Bu da virüsün diğer vücut sıvılarının içinde bir kişiden diğerine iletilmesi ile gerçekleşebilir. HIV, korunmasız cinsel ilişki, direkt kan teması, organ nakilleri ve anneden bebeğine olmak üzere dört yolla bulaşabilir. ⓘ
Cinsel ilişki
HIV ile enfekte kişinin spermi, anal, oral ya da vajinal yoldan yapılacak cinsel ilişki sırasındaki vücut sıvıları ve kan yoluyla bulaşabilir. Lateksten yapılmış bir prezervatif kullanarak HIV'den korunulabilir. Doğum kontrol hapları ve lateks olmayan prezervatifler, HIV'den koruma sağlayamaz. ⓘ
HIV, hem bir erkekten hem de bir kadından bulaşabilir. Herhangi bir cinsel hastalık, HIV'in bulaşma ihtimalinden daha yükseltir. ⓘ
HIV'in iki tipi mevcuttur. Tip II de kadından erkeğe bulaşma ihtimali, Tip I de ise erkekten kadına bulaşma ihtimali daha yüksektir. Afrika da ikinci tip Avrupa ve Amerika'da ise birinci tip daha sık görülür. ⓘ
Damardan uyuşturucu madde kullanımı
HIV ile yaşayan birisiyle kontamine bir iğne paylaşılırsa, virüs bulaşabilir. (Bu intravenöz (damardan) uyuşturucu bağımlıları arasında HIV'in en önemli bulaşma yoludur.) Dövme ve vücuda piercing yaptırma işlemlerinde kullanılan iğneler, kontamine ise HIV bulaşabilir. ⓘ
Organ, kan ve kan ürünleri nakli
Gerekli araştırma testleri yapılmamış organ, kan ve kan ürünleri nakli yoluyla da HIV bulaşabilir. Bu durumun engellenmesi için her türlü organ, doku, kan ve kan ürünleri nakli öncesi nakle engel hastalıklar yönünden alınan materyaller kabul eden merkezler tarafından dikkatle kontrol edilir. Araştırma testlerinin pencere döneminde bulunan hastalarda yalancı negatif sonuç vermesi halinde, bulaşma gerçekleşebilir. ⓘ
Anneden bebeğe
HIV ile yaşayan bir anne, virüsü bebeğine anne sütü aracılığıyla bulaştırabilir. ⓘ
Belirti
HIV bulaş gerçekleştikten sonra 2-4 hafta aralığında yüksek ateş, boğaz ağrısı, lenf bezlerinde şişlikler halsizlik grip benzeri belirtiler verir sonrasında kendiliğinden geçer. HIV'in kendine özgü belirtileri bulunmadığından belirtilerin HIV e ait olduğu ancak ELISA testi aracılığıyla belli olur. Belirtilere göre HIV olup olmadığı anlaşılamaz. HIV enfekte olmuş kişi ayrıca hiç belirti görmeyedebilir. ⓘ
HIV testleri
Pencere dönemi
Pencere dönemi ile ilgili belirsizlikleri gidermek için bazı açıklamalar yapılmalıdır; zira "Üç Ay" ifadesi, HIV virüsüne maruz kalmış her bünyenin 'üçüncü ayda' antikor üreteceği gibi yaygın bir yanılgıya yol açmaktadır. Halbuki pencere döneminin kişiden kişiye değişiklik gösterdiğini vurgulamak gerekir. "Üç Aylık" süre, uluslararası sağlık kuruluşlarının tüm bünyesel farklılıkları da kapsayacak şekilde belirlediği 'maksimum' süredir. Yani bu, HIV ile enfekte olmuş yüz kişiden varsayalım ki %45'inin, 35. günde; %25'inin 50. günde; %15'inin 65. günde; %10'unun 75. günde; %5'inin de 90. günde yeterli antikor seviyesine ulaşacağı anlamına gelir (Oranlar tamamen kurgusaldır). O halde belirlenmiş olan "üç ay" sınırı, 'en geç antikor üreten bünyeyi' de hesaba katarak düşünülmüş 'maksimum' sınırdır. ⓘ
CDC (Center of Disease Control -USA) gibi bazı büyük sağlık örgütleri, testin altıncı ayda tekrarlanması gerektiğini savunmaktadır. Antikor oluşturma (serokonversiyon) süreci üç ayı geçen çok nadir bazı vakalar rapor edilmişse de bunlar o kadar nadirdir ki, tıp makalelerine konu olur. Birçok sağlık örgütü eğer çok kesin bir risk yoksa, 'altıncı ay' testini gereksiz bulmakta ve CDC'yi tutucu olmakla eleştirmektedir. Bazı kuruluşların 'pencere dönemi' ile ilgili olarak verdikleri süreler, "Üçüncü Ay"ın maksimum sınır olarak düşünülmesi gerektiğini kanıtlamaktadır:
- New York Sağlık Müdürlüğü’nün hazırladığı broşüre göre "New York’ta kullanılan HIV antikor testlerinde, enfekte olmuş insanların neredeyse tümü bir ayda pozitif çıkmaktadır. Hatta bunların çoğunluğu, daha kısa surede bile pozitif sonuc vermektedir."
- Kaliforniya AIDS Merkezi'nin 1998'de yayınladığı rehber %96'dan daha fazla sayıda insanın, 2 ile 12 hafta arasında pozitif sonucu eline alacağını söylüyor. Çok nadir bazı durumlarda, bunun altı aya uzayabileceği belirtiliyor. AIDS Sağlık Projesi (ABD) danışmanları, ortalama süreyi 25 gün olarak veriyorlar. AIDS Update 98 adlı broşür, "Çoğu örnekte, HIV antikorları 6 ile 8. haftada görünür hale gelirler" demektedir.
- Bu konuda son derece zengin bir arşivi olan HIVinsite web sitesi, süreyi 6-12 hafta olarak belirliyor.
- Amerikan Seattle & King County Kamu Sağlığı Sitesi, şöyle diyor: “Çoğu insan, saptanabilir antikor düzeyine 4-6 hafta içinde gelir. Bazı insanların daha uzun sürebilir; ama neredeyse %99'u üç ay içinde antikor üretmiş olur. Üç ayı gecen serokonversiyon olayları çok çok nadirdir.”
- AIDS servislerinde ve laboratuvarlarında çalışan doktor ve virologlarin (Dr. Sindy Paul, Evan M Cadoff, Eugene Martin) yazdığı, "Rapid Diagnostic Testing for HIV – Clinical Implications" (Business Briefing: Clinical Virology & Infectious Disease, 2004) adli makalede, pencere dönemi 30-60 gün olarak veriliyor.
- San Fransisko AIDS Derneği, şöyle demektedir: "Üç aylık pencere dönemi, insanların tümü için normal süredir. Bu insanların çoğu, üç ile dört hafta içinde saptanabilir düzeyde antikor üretir. çok, çok nadir durumlarda, bir insanin antikor üretmesi altı ayı bulabilir."
- Kızılay, antikorların tespit edilme suresini 2-6 hafta olarak veriyor.
- Kızılhac, antikorlarin tespit edilme süresini en geç 70 gün olarak veriyor.
- Amerikan Kamu Sağlığı Kurumu'nun Test Kılavuzunda, 1985-90 yılları arasında kullanılan antikor testinin pencere döneminin ortalama 45 gün olduğu söyleniyor. Fakat günümüzdeki testlerin, bunu 20 gün daha düşürerek, 25 güne indirdiği belirtiliyor.
- BERNARD WEBER, EL HADJI MBARGANE FALL; ANNEMARIE BERGER ve HANS WILHELM DOERR'in birlikte yazdıkları makalede, pencere dönemi ortalama 10.2 ile 27.4 güne kadardır şeklinde belirtiliyor. ⓘ
Tedavi
HIV/AIDS'in tedavisinde olumlu gelişmeler vardır. HIV/AIDS, günümüz itibarıyla antiretroviral ilaçlar ile kontrol altında tutulabilmektedir. Bu ilaçlar, günde en az bir adet ya da farklı ilaç kombinasyonları ile kullanılabilmektedir. Ancak HIV/AIDS, doktor kontrolünde ve kesintisiz antiviral tedavi ile kontrol edilebilmektedir. Bu şekilde HIV pozitif kişilerin kaliteli ve uzun bir yaşam sürdürebilmeleri sağlanmaktadır. Uzun yıllardır aşı bulma çalışmaları sürmesine rağmen henüz olumlu bir sonuç elde edilememiştir. Çalışmalar ise farklı ülkelerde DSÖ(Dünya Sağlık Örgütü) desteği ile sürdürülmektedir. ⓘ
Korunma
Spermdeki ve vajina salgısındaki HIV, dış ortamda birkaç saatte, kuru ortamda ise yarım saatte ölür. HIV kurumuş kanda da kısa zamanda ölür. ⓘ
Hastanın ya da seropozitif kan, sperm veya vajina salgısının bulaştığı eşyadaki HIV'in öldürülmesi: Eşyayı birkaç dakika kaynatarak ya da 60 C°'de 30 dakika ısıtarak virus öldürülür. Sulandırılmış çamaşır suyu temas ettiği HIV'i 10 dakika içinde öldürür. Sodyumhipoklorid, çamaşır suyunda bulunan etkili maddedir, içinde klor vardır. Çamaşır suyu şişesinin üzerindeki tarifeye göre (genellikle 10 kez) sulandırılarak kullanılır. Sulandırılan çamaşır suyunda klor kokusu bulunmalıdır. Çamaşır suyu kullanılacağı zaman sulandırılmalıdır, durmakla bozulur. Çamaşır suyu madensel eşyaya zarar verir. ⓘ
Ultraviyole ile ışınlama (mavi ışık) HIV'in yok edilmesi için önerilmeyen bir yöntemdir. Ultraviyole ışını doğrudan temas ettiği yüzeydeki mikropları öldürür. Cismin altında kalan mikropları öldürmez. ⓘ
Deri HIV'den nasıl arındırılır?
Su ve sabunla iyice yıkama ile (en az 15 saniye) bütün mikroplar gibi HIV de deriden uzaklaştırılabilir. Yıkandıktan sonra derinin alkol ile temizlenmesi uygun olabilir. Yaralanma durumunda yara yeri, önce sabun ve su ile iyice yıkanmalı, ardından tentürdiyot veya betadin gibi bir antiseptik ile temizlenmelidir. ⓘ



